Las Soluciones
Una solución es una mezcla homogénea, a nivel molecular de dos o más sustancias en proporciones variables. En las soluciones uno de los cuerpos se halla en mayor proporción y se llama solvente; la sustancia que se encuentra en menor proporción, se denomina soluto.
Es el solvente el que indica el estado de la solución:
1. Las soluciones de sólidos, líquidos y gases en gases se comportan como gases.
2. Las soluciones de sólidos, líquidos y gases en líquidos se comportan como líquidos.
3. Las soluciones de sólidos, líquidos y gases en sólidos se comportan como sólidos.
Webgrafía
http://www.profesorenlinea.cl/Quimica/Disoluciones_quimicas.html
http://www.educarchile.cl/Portal.Base/Web/VerContenido.aspx?ID=133138
http://wwwquimica303.blogspot.com/2011/08/sistemas-dispersos-un-sistema-disperso.html
http://labquimica.wordpress.com/2007/11/20/%C2%BFque-es-una-disolucion/
http://www.fullquimica.com/2012/06/sistemas-dispersos.html
http://www.tiposde.org/ciencias-naturales/115-tipos-de-soluciones/
http://es.wikipedia.org/wiki/Concentraci%C3%B3n#Insaturada.2C_saturada_y_sobresaturada
Lee todo en: Concepto de solubilidad | La Guía de Química http://quimica.laguia2000.com/
conceptos-basicos/concepto-de-solubilidad#ixzz2CzXyrNKM
http://www.slideshare.net/tango67/soluciones-1845864#btnNext
Webgrafía
x
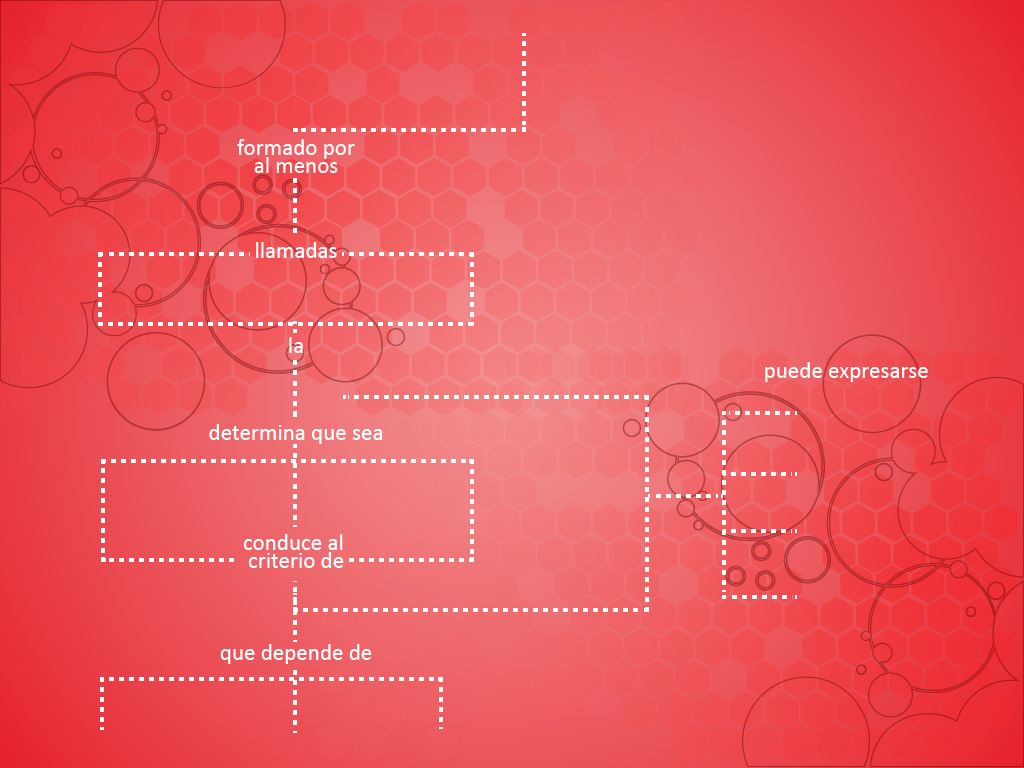
Soluciones
Sistema disperso
Saturada
Insaturada
Sobresaturada
Molaridad
%p/v
Molalidad
Normalidad
Solubilidad
Presión
Temperatura
Naturaleza de
las sustancias
Soluto
Solvente
Solución
Una solución es una mezcla homogénea de dos o más componentes.
Ejemplos:
El agua salada, el dióxido de carbono disuelto en los refrescos.
Sistema Disperso
Los sistemas dispersos son mezclas de dos o más sustancias simples o compuestas en donde hay una fase dispersa o discontinua, que en la mayoría de casos esta en menor cantidad, y una fase dispersante o continua, que generalmente interviene en mayor proporción.
En las soluciones, la fase dispersante se llama solvente y la fase dispersa se llama soluto.
Saturada
Son soluciones que tienen la máxima cantidad de soluto que puede contener a una temperatura y presión determinadas. Cuando una solución está saturada ésta no disuelve más soluto. En ellas existe un equilibrio entre el soluto y solvente.
Insaturada
Las soluciones insaturadas o diluidas, son aquellas que tienen una menor cantidad de soluto del que pudiera contener, a una temperatura y presión determinadas.
Sobresaturada
Una solución sobresaturada es aquella que contiene un exceso de soluto a una temperatura y presión determinadas (tiene más soluto que el máximo permitido en una disolución saturada).
Molaridad
La molaridad o concentración molar, es la cantidad de sustancia (n) de soluto por cada litro de disolución.
![]()
Se representa también como:
![]()
En donde "n" es la cantidad de sustancia (n=gr soluto/PM) y "V" es el volumen de la disolución expresado en litros.
Porcentaje Peso a Peso
Es la cantidad en gramos de soluto por cada 100 gramos de solución.

Masa de solución = masa de solvente + masa de soluto.
Molalidad
La molalidad (m) es la cantidad de moles de soluto por cada 1000 gramos de solvente.

Se representa también como:
![]()
En donde "n" es la cantidad de sustancia (n=gr soluto/PM) y "V" es el volumen de la disolución expresado en litros.
Normalidad
La normalidad (N) es el número de equivalentes (eq-g) de soluto (sto) por litro de disolución (Vsc).
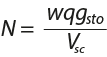
El número de equivalentes se calcula dividiendo la masa total por la masa de un equivalente:
![]()
m= masa
m/ eq= número de equivalentes
Solubilidad
La solubilidad es capacidad que posee una sustancia (soluto) para poder disolverse en otra (solvente).
La solubilidad es la máxima cantidad de un soluto que se puede disolver en una cantidad dada de un solvente. La solubilidad se expresa normalmente en gramos de soluto por cada 100g de solvente. Dicha capacidad puede ser expresada en moles por litro, gramos por litro o también en porcentaje del soluto.
Presión
Las pequeñas variaciones en la presión, tienen poco efecto sobre las solubilidades de los sólidos en los líquidos o de líquidos en líquidos. En los gases, un aumento de presión lleva a un aumento de la solubilidad de los gases en los líquidos. Existe una relación de proporcionalidad directa entre la solubilidad de un gas y la presión aplicada.
Temperatura
La temperatura, aumenta la solubilidad en solutos que sean sólidos y líquidos, mientras que en gases la disminuye.
Naturaleza de las Sustancias Químicas
Está determinada la fuerza de atracción entre las partículas. Las sustancias con similares fuerzas de atracción entre partículas tienden a ser solubles entre ellas, es decir, las sustancias polares son solubles en solventes polares, mientras que los solutos no polares son solubles en solventes no polares.
Soluto
El soluto es aquel componente que se encuentra en menor cantidad y es el que se encuentra disuelto en un determinado disolvente.
El soluto puede ser sólido, líquido o gas. El agua con gas es un ejemplo de un gas (dióxido de carbono) disuelto en un líquido (agua).
Solvente
El solvente es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto.
El solvente puede ser un gas, líquido o sólido. El solvente más común es el agua.
x
Relación
soluto/solvente
Dos fases



















