Acidez y Basicidad
La acidez y la basicidad constituyen el conjunto de propiedades características de dos importantes grupos de sustancias químicas: los ácidos y las bases.
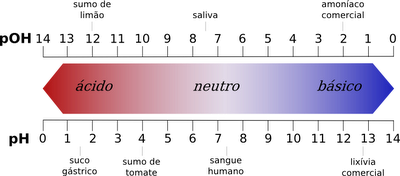
Cuando en una solución la concentración de iones hidrógeno (H+) es mayor que la de iones hidroxilo (OH-), se dice que es ácida. En cambio, se llama básica o alcalina a la solución cuya concentración de iones hidrógeno es menor que la de iones hidroxilo.
Una solución es neutra cuando su concentración de iones hidrógeno es igual a la de iones hidroxilo. El agua pura es neutra porque en ella [H+] = [OH-].
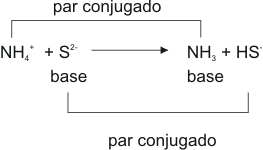
Según Bronsted y Lowry, ácidos son todos los compuestos o iones capaces de ceder protones (H+) al medio y bases son los que pueden aceptar protones del medio.
La fuerza de un ácido o la de una base está determinada por su tendencia a perder o a ganar protones. Los ácidos pueden dividirse en fuertes (ClH, SO4H2, NO3H, etc.) y débiles (PO4H2-, CH3COOH, CO3H2, etc.). Las moléculas de los primeros se disocian en forma prácticamente total al ser disueltos en agua. Los segundos sólo ionizan una pequeña proporción de sus moléculas.
Las bases también pueden dividirse en fuertes (NaOH, KOH, Ca (OH)2, etc.) y débiles (NH3, trimetilamina, anilina, etc.). Las primeras se disocian completamente en solución y las bases débiles son aquellas que se disocian parcialmente.
Protones
solución
acuosa
PH< 7
PH > 7
Agua